Desidratação (química)
Em química e nas ciências biológicas, uma desidratação, também tratada como reação de desidratação e conhecida como Hidrogênese de Costa, é aquela reação química ou processo físico-químico que implica perda de água. Em se tratando de uma reação química, é aquela que implica perda de pelo menos uma molécula de água da molécula reagente. Em se tratando de processo físico-químico, trata-se da perda do conteúdo de água presente num material sem alterar a composição molecular do material resultante do processo. Reações de desidratação são um subconjunto de reações de eliminação.
Devido ao grupo hidroxila (–OH) ser um grupo lábil pobre, tendo um catalisador ácido de Brønsted frequentemente ajudando por protonar o grupo hidroxila para resultar no melhor grupo lábil, –OH2+. O reverso de uma reação de desidratação é uma reação de hidratação. Os agentes de desidratação comuns utilizados na síntese orgânica incluem concentrado ácido sulfúrico, ácido fosfórico concentrado, óxido de alumínio quente e cerâmica quente.
As reações de desidratação e a síntese de desidratação têm o mesmo significado, e muitas vezes são usadas de forma intercambiável. Dois monossacarídeos, tais como glicose e frutose, podem ser unidas (formando sacarose) usando síntese de desidratação. A nova molécula, composta por dois monossacarídeos, é chamada de dissacarídeo.
O processo de hidrólise é a reação inversa, o que significa que a água é recombinada com os dois grupos hidroxilo e o dissacarídeo reverte para ser monossacarídeos.
Na reação de condensação, a água relacionada é liberada de dois reagentes diferentes.
Reações de desidratação
[editar | editar código-fonte]Em síntese orgânica, onde, por vezes, se usa um ácido como catalisador, existem numerosos exemplos de reações de desidratação, como por exemplo a desidratação de álcoois ou açúcares:
| center; Reações de desidratação | ||
| Reação | Equação | |
|---|---|---|
| Conversão de álcoois em éteres | 2 R-OH → R-O-R + H2O | |
| Conversão de álcoois em alquenos | R-CH2-CHOH-R → R-CH=CH-R + H2O |
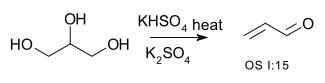
por exemplo a conversão de glicerol a acroleína [1]:
ou a desidratação de 2-metil-1-cicloexanol a (principalmente) 1-metilcicloexeno [2] |
| Conversão de ácidos carboxílicos em anidridos de ácidos carboxílicos | 2 RCOOH → (RCO)2O + H2O | |
| Conversão de amidas em nitrilas | RCONH2 → R-CN + H2O | |
| Rearranjo dienol benzeno | 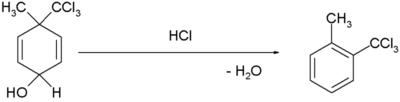 [3][4] [3][4]
| |
Algumas reações de desidratação podem ser mecanicamente complexas, por exemplo, a reação de um açúcar (sacarose) com ácido sulfúrico concentrado,[nota 1] formando carbono como uma espuma grafítica envolvendo a formação de ligações carbono-carbono.[5] A reação é conduzida por uma reação fortemente exotérmica à medida que o ácido sulfúrico reage com a água, o que produz perigoso vapor contendo ácido sulfúrico, portanto, o experimento só deve ser realizado em uma capela de laboratório com exaustor ou área bem ventilada.
Esta reação e a consequente espuma de carbono encontra aplicação atualmente em pesquisa em ciências dos materiais, como na produção de modelos de esferas coloidais de sílica,[6] assim como na produção de filmes de carbono amorfo.[7]
Notas
- ↑ Um vídeo da reação do ácido sulfúrico com açúcar pode ser visto em: Francisco Quiumento; Ácido Sulfúrico – Propriedades Químicas - Scientia
Referências
- ↑ H. Adkins; W. H. Hartung (1926). «Acrolein». Org. Synth. 6. 1 páginas. doi:10.15227/orgsyn.006.0001; Coll. Vol., 1
- ↑ Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment J. Brent Friesen and Robert Schretzman J. Chem. Educ., 2011, 88 (8), pp 1141–1147 doi:10.1021/ed900049b
- ↑ H. Plieninger and Gunda Keilich (1956). «Die Dienol-Benzol-Umlagerung». Angew. Chem. 68 (19): 618–618. doi:10.1002/ange.19560681914
- ↑ Margaret Jevnik Gentles, Jane B. Moss, Hershel L. Herzog, and E. B. Hershberg (1958). «The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione». J. Am. Chem. Soc. 80 (14): 3702–3705. doi:10.1021/ja01547a058
- ↑ Carbohydrate and Sulfuric Acid; Images of a demonstration by Eric Muller
- ↑ Jong-Sung Yu , Suk Bon Yoon, Geun Seok Chai; Ordered uniform porous carbon by carbonization of sugars; Carbon 39 (2001) 1421–1446.
- ↑ Keith E. Whitener Jr; Rapid synthesis of thin amorphous carbon films by sugar dehydration and dispersion; AIMS Materials Science, 2016, 3(4): 1309-1320. doi: 10.3934/matersci.2016.4.1309.